我们所熟知的生命,并非一组静止的结构图谱,而是一场持续进行的动态演出。每一个蛋白质分子,都在以惊人的速度完成它们的“表演”:折叠、弯曲、打开、闭合、交互……这些过程往往发生在几毫秒甚至微秒之内。可惜的是,传统结构生物学工具,如X射线晶体学和常规冷冻电子显微镜(cryo-EM),虽然能清晰捕捉蛋白质的静态形态,却如同只能拍摄一张照片,而无法捕捉动作过程的摄影机。
近年来,一种前沿技术正在打破这一局限:时间分辨冷冻电子显微镜(time-resolved cryo-EM,简称 TR cryo-EM)。自然杂志针对这项前沿技术于2025年6月16日发表了一篇文章《Freeze Frame: Cracking Molecular Motion》。这项技术结合了冷冻电镜的高分辨率成像能力与“快照式”时间记录的手段,使科学家得以在微秒级别的时间尺度上,观察蛋白质如何动态变化。
捕捉“微秒级瞬间”:科学仪器的极速挑战
蛋白质在体内的运行,往往比人类眨一次眼睛还快上千倍。要想观测这些瞬间,科学家首先面临的是样品制备的速度瓶颈。
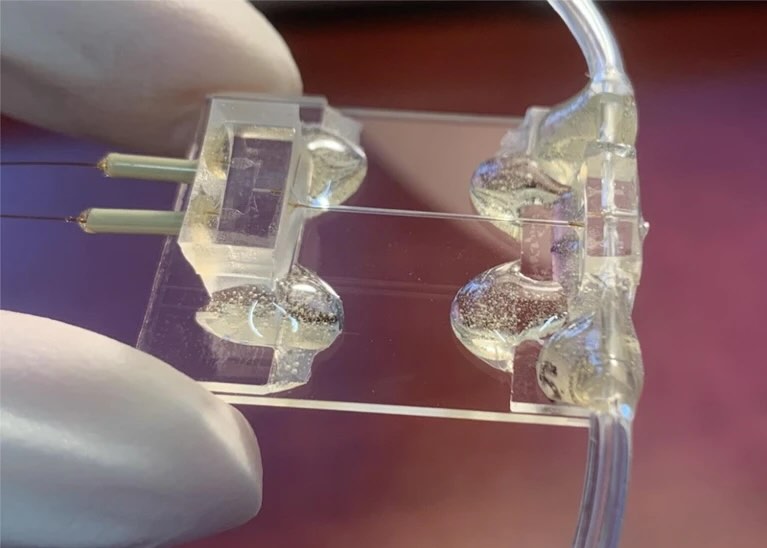
传统冷冻电镜的制样过程通常需要几秒钟的时间,这对于许多动态过程来说,早已“为时已晚”。为此,研究者设计了诸如“混合-喷射-冷冻”这样的装置:将两种溶液迅速混合后,立即以微喷射方式沉积在EM网格上,并在微秒级内冷冻锁定分子状态。
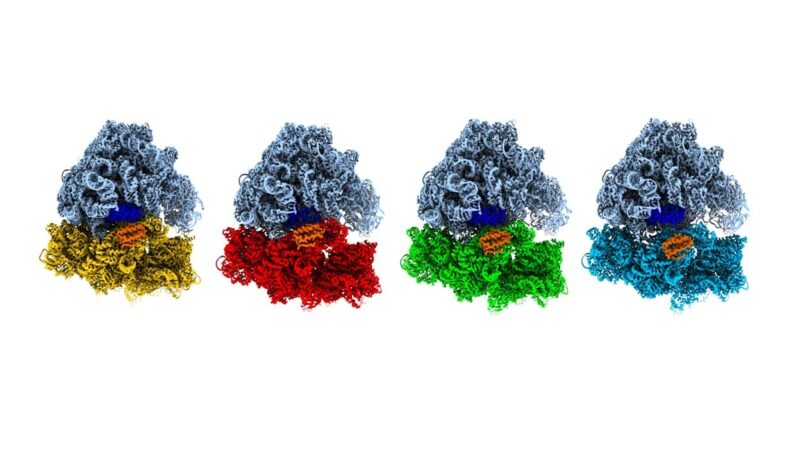
2023年,瑞士洛桑联邦理工学院的乌尔里希·洛伦茨教授团队,实现了高达10微秒时间分辨率的突破,成功捕捉了核糖体与tRNA结合过程中的短暂构象。这项成果标志着生物学家首次有能力在接近分子运动本征时间尺度上进行观察。
光触发:让蛋白质在特定时刻“演出”
另一种策略是使用光来启动分子运动。例如北京大学的毛有东团队,采用激光脉冲诱导蛋白质结构变化,并在几十微秒内完成冷冻成像,从而观察热激酶HSP90在热诱导下的运动。他们不仅获得了结构图像,更通过结合人工智能算法,重建出了蛋白质在能量景观中的完整运动路径——如同将一部高速电影逐帧拆解。
在英国,克里克研究所的研究人员则使用名为 LAMA(light-activated, millisecond, mix-and-freeze)的方法,对细胞信号传导中关键的酪氨酸激酶 Src 的激活过程进行了时间序列重建。这些研究,不仅解答了长期悬而未决的生物学问题,也揭示了潜在的药物作用靶点。

数据爆炸与算法挑战:科学“幕后”的困难
TR cryo-EM 虽然令人振奋,但并非没有挑战。它所带来的不仅是大量图像数据,更是一种“时间序列”的信息重建问题。一个蛋白质在不同时间点的不同构象,需要通过复杂的分类、聚类、重构算法进行整合,以还原其真实的动态轨迹。
更复杂的是,实验中每一次的混合、触发、冷冻,往往都略有偏差,难以实现完全同步。没有标准化的设备与流程,研究人员只能依靠精密控制与经验积累。这也使得目前全球真正能够熟练开展 TR cryo-EM 实验的实验室,仍然寥寥无几。
“这项技术还不够平民化。”一位从业者坦言,“成本高、设备少、通量低,是主要障碍。”但她也补充说,“就像当年的冷冻电镜一样,一旦技术标准化并走入平台化,前景不可限量。”
“活结构”时代的来临
科学家们早已意识到,真正的生命奥秘隐藏在动态之中。病变蛋白质、药物结合、酶促反应、能量转移——这些过程都不是静态完成的。TR cryo-EM 的出现,首次让我们有可能以接近自然的方式“看到”蛋白质在工作的全过程。
在这个新的时代,“结构生物学”或许将被“动态结构生物学”所取代;生物医学的靶点也将从“单一构象”走向“构象分布与能量路径”。


