实验室“定向进化”打造出超越传统CRISPR的基因编辑利器
一项突破性的基因编辑技术正在改变CRISPR的能力边界:它不仅能精准地将完整基因插入人类DNA,而且操作简便、效率显著提升。该成果2025年5月15日发表于自然科学(Science)杂志《Powerful CRISPR system inserts whole gene into human DNA》,有望为一次性治愈型基因疗法、癌症细胞工程治疗及疾病模型的构建打开全新通道。
“这很可能是未来基因治疗的重要组成部分。”论文共同作者、大名鼎鼎的布罗德研究所(Broad Institute)化学生物学家大卫·刘(David Liu)表示。此时此刻,英国已经率先批准了CRISPR的疾病治疗方案,这项具有里程碑意义的决定可能会改变镰状细胞病和β-地中海贫血的治疗方式——但这一技术成本高昂。目前英国批准的治疗方案自然杂志也在《UK first to approve CRISPR treatment for diseases: what you need to know》做了详细的分析,为其他国家和地区的治疗方案发展提供了参考。
靶向插入新纪元:打破病毒与传统CRISPR的局限
目前,最常见的基因传递手段依赖于改造病毒将遗传物质植入细胞基因组。尽管有效,但病毒载体随机插入的特性往往带来基因表达失控甚至基因破坏的风险。
CRISPR虽提供了更强的靶向性,但通常需要对DNA进行切割,这增加了非预期突变和修复不全的可能性。此外,每种突变都需设计特定模板,限制了其可扩展性。
而最新研发的系统——名为“evoCAST”的CRISPR-相关转座酶系统(CRISPR-associated transposase, 简称CAST)突破了这一瓶颈:它能在不切割DNA、无需为每次操作定制模板的前提下,实现完整基因的精准单步插入。这项研究成果刊登在2024年1月12日的自然杂志《Bacterial genome engineering using CRISPR-associated transposases》。
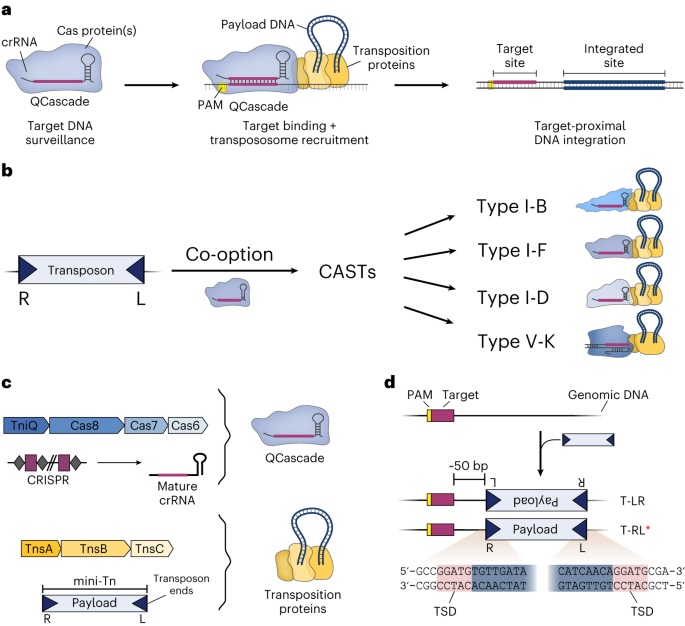
该系统由刘博士与哥伦比亚大学生物化学家萨缪尔·斯特恩伯格(Samuel Sternberg)团队联合开发,核心是源自细菌的天然“跳跃基因”酶类——转座酶。这些酶天然可使DNA片段在基因组中“跳跃移动”,过去已有研究将其改造用于细菌基因的大规模重排。但在哺乳动物细胞中,原有CAST系统插入效率极低,难以应用。
实验室定向进化打造“超级转座酶”
为了提升性能,研究团队借助“定向进化”技术对CAST系统进行了深度优化。通过将关键CAST组件基因导入噬菌体(感染细菌的病毒),并筛选出插入效率最高的病毒株,科学家们在数百代进化与结构理性设计后,获得了一个包含21处氨基酸突变、覆盖5种蛋白质的全新高效转座复合体——evoCAST。
“这几乎是疯狂的定向进化!”日本理化学研究所(RIKEN)生物工程专家斋藤诚(Makoto Saito)评论道。
evoCAST在实验中表现出惊人的效率:在多个基因组靶点的插入率最高可达30%,相比未经优化的系统提高了400多倍。同时,它成功地将长度超过10,000个碱基的完整基因及其调控元件导入人类细胞,包括被称为“基因组安全港”的区域和与疾病相关的基因自然位点。
更重要的是,这一过程无需对DNA造成双链断裂,仅依赖酶促反应单步完成,大幅降低了基因组不稳定风险。
工具百花齐放:转座酶编辑技术进入黄金时代
在evoCAST之外,多个研究团队也在竞相开发无需切割DNA即可实现大段插入的CRISPR转座酶技术。
今年4月,哈佛医学院的乔纳森·古滕伯格(Jonathan Gootenberg)与奥马尔·阿布达伊耶(Omar Abudayyeh)团队提出一种源自鸟类基因组的移动元件,并与不切割DNA的CRISPR酶融合,实现了基因级别的插入能力。
与此同时,加州生物技术公司Metagenomi在3月也公布了一种更为紧凑的转座系统,虽然效率不如evoCAST,但因体积小巧更适合未来在体治疗中的递送。

“我们正处于工具开发的黄金时代。”古滕伯格在美国基因与细胞治疗学会(ASGCT)年会上表示,“我们希望这些进展最终能够真正转化为病人的福音。”
应用前景与挑战并存
尽管前景广阔,这些新技术也并非毫无瑕疵。以evoCAST为例,尽管非靶向插入事件极少,仍无法完全避免。此外,其复杂的蛋白结构也带来包装与递送的难题。
“能达到这个程度已经非常令人震撼了。”德克萨斯大学奥斯汀分校生物物理学家伊利亚·芬克尔斯坦(Ilya Finkelstein)说,“但这个系统确实复杂。”
尽管如此,evoCAST的诞生以及其他转座系统的不断出现,预示着大容量、安全基因递送技术的新时代正在开启。
“这正是工程的魅力所在。”斯特恩伯格总结道,“我们总能让它变得更好。”